Photoeffekt und Lichtquanten
Wasserstoff-Linienspektrum
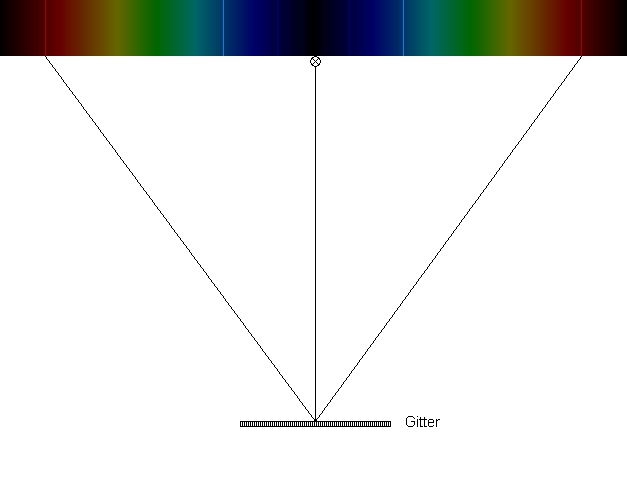
Was passiert?
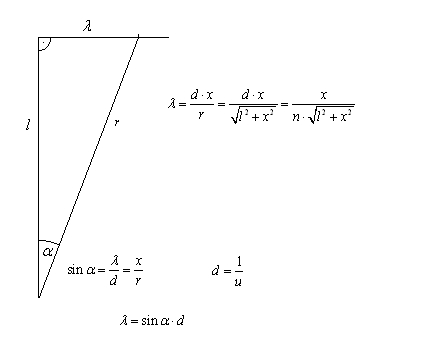
Eine mit Wasserstoff gefüllte Röhre (Balmerlampe) wird durch Gasentladung zum Leuchten gebracht. Das ausgesandte Licht wird mit einem untersucht.
Die Balmer Formel
Balmer untersuchte die vier Linien des Wasserstoffspektrums, die im sichtbaren Spektralbereich liegen. Ihre Wellenlängen sind 410nm (violett), 434nm (blau), 486nm (grün) und 656nm (rot). Er fand heraus, dass alle Wellenlängen durch folgende Beziehung dargestellt werden können:
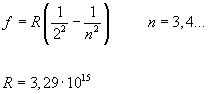
Die Allgemeine Formel
Durch die Balmerformel können nur die Linien des Wasserstoffatoms beschrieben werden, die im sichtbaren Spektralbereich liegen. Linien im ultravioletten oder infraroten Bereich können mit ähnlichem Formalismus beschrieben werden. Um das einmal zu veranschaulichen soll folgende Skizze helfen:
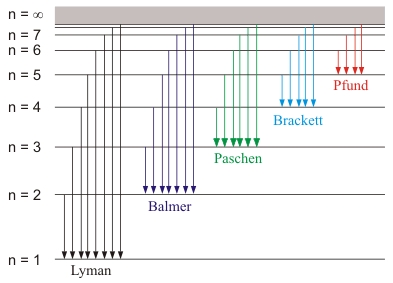
Hier gilt also allgemein:
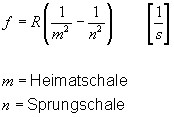
Die entstehende Energie
Wenn ein Elektron im Wasserstoffatom von einer auf eine andere Bahn und zurück springt entsteht dabei Energie. Diese kann man folgendermaßen berechnen:
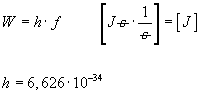
Die Spektroskopie